Москва, г. Москва и Московская область, Россия
Физические и химические свойства определяются числом и расположением ядер и электронов. Превращения веществ сопровождается тепловыми эффектами и изменениями объема, который формируется электронными оболочками атомов. Электронные оболочки меняют свою форму и объем в зависимости от окружения их другими атомами. Тепловые процессы достаточно подробно рассмотрены в многочисленных работах по химической термодинамики, а информации по изменениям объемов недостаточно. Представлены расчеты, отображающие взаимодействия алюминия с другими атомами.
концентрация электронов, плотность, структура
Введение. В работах [1-9] представлены результаты расчетов по межатомным взаимодействиям. В работах [10,11] представлены результаты расчетов по межмолекулярным взаимодействиям.
Взаимосвязь между структурными характе-ристиками и свойствами представлена в работах [12,13]. Конденсированное состояние характеризуется наполненностью ядрами атомов и электронами.
Изменение структуры вещества без изменения химического состава всегда сопровождается изменением взаимодействия электронов в веществе (фазовые превращения) [14,15]. Изменения объемов наряду с тепловыми эффектами могут характеризовать межмолекулярные и межатомные взаимодействия. Химические превращения определяются взаимо-действием электронных оболочек атомов и молекул.
Приведенные ниже вычисления построены на основании справочных данных по плотности веществ в конденсированном состоянии [16-18].
Целью настоящей работы было выявить возможность использования нормированной величины изменения объема как характеристики, позволяющей оценивать интенсивность взаимодействия между разнородными атомами, а концентрацию электронов и концентрацию ядер атомов, определяемых в единицах моль/см3, в качестве величины, позволяющей оценить структуру материала.
Методы. В работах [1-9] представлена формула для определения концентрации электронов гомонуклеарных веществ на основании справочных данных по их плотности в конденсированном состоянии:
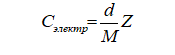 (1)
(1)
где Сэлектр – концентрация электронов в единице объема, моль/см3;
d – плотность вещества в конденсированном состоянии, г/см3;
М – молярная масса, г/моль;
Z – порядковый номер элемента в таблице Менделеева.
Соединение типа AaBb имеет концентрацию электронов
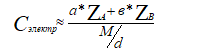 (2)
(2)
где a - подстрочный индекс элемента A ,
ZA – порядковый номер элемента A,
b – подстрочный индекс элемента B,
ZB – порядковый номер элемента B,
Соединение типа AaBb имеет концентрацию ядер атомов (независимо от их сорта)
![]() (3)
(3)
Чем выше концентрация ядер, тем короче межъядерные расстояния. Сплавы металлов не являются простой смесью различных компонентов, а представляют собой различные химические соединения из элементов, которые образуют сплав.
Для оценки глубины взаимодействия между атомами удобно сравнивать объемы веществ до реакции (Vкомпон.) и объемы веществ после реакции (Vпрод.). Полученную величину нормируем к объему конечного продукта. Результат, выраженный в процентах, характеризует изменение объемов веществ в процессе реакции. Обозначим эту величину – коэффициент уплотнения (Купл.):
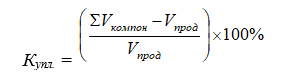 (4)
(4)
Формула 4 может быть представлена в виде
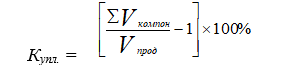 (4а)
(4а)
Коэффициент уплотнения может быть, как положительным, так и отрицательным. Это означает, что продукт реакции может иметь объем меньший, чем сумма объемов исходных элементов, а может быть больше суммы исходных объемов (разрыхление электронных оболочек). Алюминий в твердом состоянии имеет объем одного моля атомов 9,99 см3, концентрацию электронов 1,301 моль/см3, концентрацию ядер 0,100 моль/см3.
В таблице 1 приведены характеристики бинарных соединений алюминия. Столбцы 2, 3 и 4 заполнены на основании расчетов по формулам 4, 2 и 3 используя данные из [10,11]. Столбец 5 заполнен данными из [19].
Таблица 1 - Структурные характеристики бинарных соединений алюминия.
|
Вещество |
Купл, % |
Сэлектр моль/см3 |
Сядер моль/см3 |
-ΔHº298 кДж/моль |
|
1 |
2 |
3 |
4 |
5 |
|
AlH3 |
145,4 |
0,787 |
0,197 |
12 |
|
LiAl Li3Al2 Al4Li9 |
18,7 17,1 16.9 |
0,826 0.694 0.588 |
0,103 0.099 0.097 |
|
|
AlB2 AlB10 |
25.6 -0.7 |
1.505 1.113 |
0.196 0.194 |
|
|
Al4C3 |
16.0 |
1.450 |
0.145 |
208 |
|
AlN |
58.5 |
1.597 |
0.160 |
318 |
|
Al2O3 AlO Al2O |
37.9 -40.6 41.5 |
1.772 0.765 1.829 |
0.177 0.073 0.161 |
1675 |
|
AlF3 |
40.6 |
1.441 |
0.144 |
1510 |
|
Mg2Al3 Al2Mg |
-0.7 -0.6 |
1.080 1.111 |
0.086 0.088 |
|
|
Al4Si |
-19.7 |
1.027 |
0.078 |
|
|
AlP |
-2.2 |
1.167 |
0.083 |
|
|
Al2S3 |
3.5 |
1.152 |
0.078 |
509 |
|
AlCl3 |
17.6 |
1.203 |
0.075 |
704 |
|
Al2Ca Al4Ca |
14.6 3.7 |
1.164 1.134 |
0.076 0.079 |
|
|
AlSc2 AlSc Al3Sc Al2Sc |
3.6 6.0 8.1 7.3 |
1.432 1.447 1.445 1.445 |
0.078 0.085 0.096 0.092 |
|
|
Al3Ti Al2Ti AlTi3 AlTi |
7.4 5.9 3.8 6.6 |
1.616 1.663 1.970 1.816 |
0.106 0.104 0.100 0.104 |
|
|
AlV3 Al3V β-Al6V |
3.3 7.4 2.6 |
2.418 1.737 1.517 |
0.118 0.112 0.105 |
|
|
Cr5Al8 AlCr2 |
3.6 4.7 |
1.996 2.605 |
0.116 0.128 |
|
|
Al8Mn5 Al2Mn3 |
6.1 6.2 |
2.078 2.546 |
0.118 0.126 |
|
|
Al5Fe2 Al6Fe AlFe3 AlFe |
3.1 5.6 6.9 17.0 |
1.876 1.637 3.109 2.668 |
0.112 0.110 0.137 0.137 |
|
|
Al5Co2 AlCo |
9.9 18.1 |
2.065 2.833 |
0.121 0.142 |
|
|
Al4Ni3 AlNi Ni5Al3 AlNi3 |
7.0 14.3 11.5 5.6 |
2.434 2.824 3.168 3.436 |
0.125 0.138 0.142 0.142 |
|
|
Продолжение табл.1 |
||||
|
1 |
2 |
3 |
4 |
5 |
|
AlCu AlCu4 Al2Cu3 CuAl2 |
-2.6 4.2 -8.9 37.5 |
2.389 3.493 2.490 2.038 |
0.114 0.135 0.110 0.111 |
|
|
Al0.71Zn0.29 |
1.8 |
1.872 |
0.104 |
|
|
AlGe Al3Ge2 δ-AlGe2 |
-20.9 13.4 0.8 |
1.505 2.040 2.081 |
0.067 0.099 0.081 |
|
|
AlAs |
-13.6 |
1.722 |
0.075 |
|
|
Al2Se3 |
-6.7 |
1.721 |
0.067 |
567 |
|
AlBr3 |
7.1 |
1.447 |
0.049 |
514 |
|
Sr5Al9 SrAl Al2Sr β-Al4Sr |
22.2 14.0 25.5 12.8 |
1.430 1.307 1.474 1.362 |
0.065 0.051 0.069 0.076 |
|
|
Al3Y5 Al3Y Al2Y Y3Al2 Y3Al Y2Al |
-0.1 6.0 9.3 1.4 3.0 2.1 |
1.806 1.657 1.782 1.819 1.921 1.866 |
0.062 0.085 0.082 0.064 0.059 0.062 |
|
|
AlZr3 Al3Zr Al2Zr Al3Zr2 |
3.1 5.4 7.2 3.8 |
2.628 1.889 2.077 2.126 |
0.079 0.096 0.094 0.089 |
|
|
σ-AlNb2 Al3Nb AlNb3 |
2.5 6.4 1.4 |
3.071 2.084 3.242 |
0.097 0.104 0.095 |
|
|
Al5Mo AlMo3 |
6.3 4.8 |
1.915 3.818 |
0.107 0.110 |
|
|
Al6Tc AlTc2 |
0.5 6.8 |
1.775 3.915 |
0.103 0.119 |
|
|
Al6Ru AlRu Ru2Al3 RuAl2 |
2.7 16.2 12.5 12.1 |
1.842 3.675 3.104 2.801 |
0.106 0.129 0.122 0.120 |
|
|
AlRh Rh2Al5 |
14.8 4.4 |
3.639 2.430 |
0.125 0.110 |
|
|
Al3Pd5 AlPd Al4Pd |
8.6 9.5 2.8 |
3.935 3.426 2.062 |
0.117 0.116 0.105 |
|
|
AlAg3 Ag2Al |
1.6 0.4 |
3.836 3.519 |
0.100 0.099 |
|
|
AlSb |
-18.5 |
1.849 |
0.058 |
|
|
Al2Te3 Al5Te4 |
-17.5 -5.9 |
1.850 1.952 |
0.051 0.064 |
326 |
|
AlI3 |
-13.8 |
1.703 |
0.040 |
308 |
|
Ba3Al5 Ba4Al5 Al4Ba |
17.4 15.6 10.8 |
1.662 1.647 1.530 |
0.057 0.051 0.071 |
|
|
Al3La Al2La AlLa3 Al4La |
-1.9 4.2 -2.2 5.8 |
1.790 2.030 2.313 1.673 |
0.075 0.073 0.050 0.085 |
|
|
AlCe Al3Ce Al2Ce AlCe3 |
-15.5 -28.1 3.5 2.3 |
1.955 1.376 2.135 2.652 |
0.055 0.057 0.076 0.057 |
|
|
AlPr Al2Pr Al3Pr |
3.0 4.9 0.1 |
2.407 2.185 1.930 |
0.068 0.104 0.079 |
|
|
AlNd3 Al2Nd NdAl3 AlNd |
4.9 5.9 0.7 1.3 |
2.819 2.231 1.971 2.402 |
0.058 0.078 0.080 0.066 |
|
|
AlSm2 AlSm3 Al3Sm Al2Sm |
-0.6 -1.7 -16.2 5.8 |
2.734 2.807 2.070 2.334 |
0.060 0.056 0.082 0.080 |
|
|
Al2Eu Al4Eu |
21.3 6.1 |
2.204 1.614 |
0.074 0.077 |
|
|
Al3Gd Al2Gd Al2Gd3 AlGd |
4.0 8.1 -0.5 -3.3 |
2.142 2.426 2.717 2.481 |
0.083 0.081 0.062 0.064
|
|
|
Продолжение табл.1 |
||||
|
1 |
2 |
3 |
4 |
5 |
|
Al2Tb3 Al2Tb TbAl3 |
0.3 7.3 5.3 |
2.846 2.484 2.222 |
0.064 0.082 0.085 |
|
|
Al3Dy AlDy Al2Dy Al2Dy3 |
7.5 3.9 7.5 1.5 |
2.303 2.830 2.536 2.953 |
0.088 0.072 0.083 0.066 |
|
|
Al2Ho Al2Ho3 HoAl3 |
7.8 0.3 7.1 |
2.591 2.993 2.332 |
0.084 0.066 0.088 |
|
|
AlEr Al2Er3 Al2Er Al3Er |
3.9 1.5 8.1 7.8 |
2.954 3.093 2.638 2.378 |
0.073 0.067 0.084 0.089 |
|
|
Al3Tm Al2Tm |
7.6 8.0 |
2.416 2.690 |
0.089 0.085 |
|
|
Al2Yb YbAl3 |
21.5 22.6 |
2.676 2.438 |
0.081 0.089 |
|
|
AlLu2 Al2Lu |
3.4 8.2 |
3.514 2.777 |
0.068 0.086 |
|
|
Hf5Al3 Hf3Al2 Al3Hf Al2Hf AlHf AlHf2 |
0.7 -6.5 5.6 7.5 2.5 -0.9 |
4.142 3.757 2.701 3.155 3.723 4.228 |
0.083 0.078 0.097 0.097 0.088 0.081 |
|
|
AlTa Ta2Al3 AlTa2 Al3Ta |
-20.6 14.3 4.6 6.3 |
3.269 4.083 5.229 2.912 |
0.076 0.110 0.099 0.104 |
|
|
Al5W WAl12 |
7.2 -1.3 |
2.505 1.753 |
0.108 0.099 |
|
|
Al6Re AlRe |
0.7 30.8 |
2.238 6.115 |
0.102 0.139 |
|
|
AlOs OsAl2 Os2Al3 |
12.7 13.7 -10.6 |
5.447 4.082 4.636 |
0.122 0.120 0.121 |
|
|
Al3Ir AlIr |
5.8 16.1 |
3.366 5.625 |
0.110 0.125 |
|
|
Pt2Al AlPt3 Al2Pt |
7.8 3.7 -7.0 |
6.460 6.985 3.324 |
0.115 0.086 0.096 |
|
|
Au4Al Al2Au5 AlAu AlAu2 Al2Au |
2.3 -11.5 -0.4 6.0 -6.9 |
6.618 6.106 4.532 5.960 3.234 |
0.101 0.102 0.099 0.105 0.092 |
|
|
Al2Th AlTh2 AlTh Al2Th3 Al3Th |
-0.2 4.3 -0.9 1.5 1.4 |
2.776 3.768 3.221 3.532 2.531 |
0.072 0.059 0.063 0.060 0.078 |
|
|
Al2U Al3U |
-7.8 -10.7 |
3.347 2.752 |
0.085 0.084 |
|
|
NpAl2 NpAl3 NpAl4 |
-11.0 -10.8 -9.7 |
3.354 2.831 2.364 |
0.085 0.086 0.088 |
|
|
AlPu3 Al2Pu Al3Pu Al4Pu PuAl |
-7.6 -7.2 -5.9 -5.5 -8.6 |
5.333 3.305 2.853 2.392 4.128 |
0.072 0.083 0.086 0.088 0.077 |
|
В таблице представлено более 150 соединений, относящихся к классу интерметаллидов. Эти соединения являются перспективными, но термодинамичекие показатели во многих случаях отсутствуют. Представленные в таблице результаты помогут более целенаправленно применять соединения без предварительных испытаний.
Корреляционный анализ для галогенидов алюминия показал, что коэффициент корреляции между теплотой образования и уплотнением, а также концентрацией ядер превышает критический на уровне значимости 0,975. Это позволяет утверждать о корректности вычисленных значений.
Рассматривая ряд соединений Al2O3; Al2S3; Al2Se3; Al2Te3, легко заметить, что значения коэффициентов уплотнения являются более привлекательными для характеристик взаимодействия, чем теплота образования.
Чем выше уплотнения для однотипных соединений, тем больше теплота образования для этих химических соединений.
Можно утверждать, что химическая активность фтора, хлора, брома и иода для ряда соединений равномерно уменьшается, также и в ряду: кислород, сера, селен и теллур.
На основании полученных данных можно заключить, что изменение объема при химических реакциях надежно характеризует интенсивность межатомных взаимодействий.
Сравнение объемов веществ до реакции и после позволяет полнее раскрывать взаимодействие атомов и молекул, чем это позволяют делать тепловые эффекты.
Структуру кристаллического состояния удобнее рассматривать через показатели, которые могут характеризовать пространство, заполненное ядрами атомов и электронами. Ядра атомов образуют остов структуры, а электроны образуют взаимодействие между атомами.
Представленные в таблице 1 концентрации электронов и концентрации ядер атомов способны отображать различия и сходство структур веществ.
Выводы:
- Представлены результаты нормированной характеристики изменения объемов в бинарных соединениях алюминия.
- Предложено использовать плотность, как одну из величин, способных характеризовать взаимодействие атомов в конденсированной системе для оценки свойств веществ.
- Показано, что величины концентрации электронов и концентрации ядер атомов соединений, определяемых в единицах моль/см3, можно использовать как структурные характеристики материала.
- Для оценки степени взаимодействия исходных компонентов при образовании соединения предложено использовать коэффициент уплотнения.
1. Molchan N.V., Fertikov V.I. Determination of Concentration of Electrons for Description of the Structure of Materials, with Sulfides as an Example//Journal of Materials Sciences and Applications. – 2015. – Vol. 1, № 2. – P. 38–44.
2. Молчан Н.В., Фертиков В.И. Концентрация электронов как структурная характеристика оксидов //Техника и технология силикатов. – 2016. – Т. 23, № 2. – С. 8–14.
3. Molchan N.V., Fertikov V.I. Interrelation of Thermodynamic Parameters and Structural Characteristics, with Halides of Groups 1 and 2 Elements as an Example // American Journal of Chemistry and Application. – 2016. – Vol. 3, № 5. – P. 28–32.
4. Seguru G., Fertikov V. Interaction of Elements in Binary Compounds of Hydrogen// American Journal of Chemistry and Application. – 2017. - Vol. 4, № 6. – P. 59–62.
5. Fertikov V., Seguru G. The Interaction of Iron with the Chemical Elements, Forming Binary Compounds // SciFed Journal of Metallurgical Science – 2017. – V.1.Iss.I. P.1 -5.
6. Fertikov V., Seguru G. Assessment of Changes in Volume of Nickel Compounds Interacting With the Chemical Elements//International Journal of Current Research. – 2017 - V.9, Iss. 08. P.56361-56364.
7. Seguru G., Fertikov V. Interatomic Interactions in Binary Nitrogen Compounds // International Journal of Innovation in Engineering Research & Management. – 2018 – V. 05. Iss. 02. P. 1-5.
8. Молчан Н.В., Кривобородов Ю.Р. Фертиков В.И. Взаимодействие кремния с химическими элементами, образующими с ним бинарные соединения. // Техника и технология силикатов. – 2017. – Т. 24, № 4. – С. 11–17.
9. Молчан Н.В., Кривобородов Ю.Р. Фертиков В.И. Межатомные взаимодействия в бинарных соединениях кальция. // Техника и технология силикатов. – 2018. – Т. 25, № 4. – С. 106–109.
10. Молчан Н.В., Кривобородов Ю.Р. Фертиков В.И. Взаимодействие воды с оксидами, образующими гидроксиды и кристаллогидраты//Техника и технология силикатов. – 2017. – Т. 24, № 1. – С. 11–16.
11. Молчан Н.В., Кривобородов Ю.Р. Фертиков В.И. Межмолекулярные взаимодействия в двухкомпонентных оксидных системах с SiO2// Техника и технология силикатов. – 2018. – Т. 25, № 3. – С. 80–84.
12. Молчан Н.В., Фертиков В.И. Сжимаемость веществ и размеры атомов // Материаловедение. – 2011. – Т. 171, № 6. – С. 2–6.
13. Молчан Н.В., Фертиков В.И. Концентрация электронов и механические свойства веществ. В сб.: ТестМат – 2013. Сборник докладов Всероссийской конференции по испытаниям и исследованиям свойств материалов. 2013. С. 9
14. Molchan N., Eliseev D., Fertikov V. Control of Nickel Alloy Structural Change by the Atomic Emission SpectroscopyMethod // American Journal of Analytical Chemistry. – 2016. – Vol. 7, № 9. – P. 633–641.
15. Молчан Н.В., Фертиков В.И. Контроль изменения структуры стали при отжиге етодом атомно-эмиссионной спектроскопии. // Заводская лаборатория. Диагностика материалов. -2016. –Т.82, №5. –С.39-43.
16. International Centre for Diffraction Data. JCPDS PCPDFWIN. – 2002. – V. 2.03.
17. Новый справочник химика и технолога. Основные свойства неорганических, органических и элемент-органических соединений. – СПб.: Профессионал, 2007. – 1276 с.
18. Физические величины: справочник / А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; под ред. И. С. Григорьева, Е. З. Мейлихова. – М.: Энергоатомиздат, 1991. – 1232 с.
19. Константы неорганических веществ. Справочник / Р.А.Лидин, Л.Л.Андреева, Л.Л.Молочко; под ред. Лидина Р.А. М.: «Дрофа», 2006. 685 с.









