Отработана технология получения биокомпозиционных материалов на основе нейтральных и высокощелочных матричных стекол и наполнителей – кальций дефицитного гидроксиапатита и микропористого цеолита. Полученные композиционные материалы обладают регулируемой поровой структурой и регулируемым размером пор. Введение цеолита в состав композиционных материалов приводит к образованию в материале открытых пор малых размеров и повышает его проницаемость. Установлено, что параметрами регулирования поровой структуры полученных материалов являются: введение газообразователя, изменение соотношения доли стекла в композиции к доле наполнителя, использование наполнителей большего гранулометрического размера. Оптимизированы составы композиционных материалов, приближающихся по уровню свойств к трабекулярной костной ткани.
биокомпозиционные материалы, гидроксиапатит, цеолит, технология получения, пористость
Введение. В настоящее время наибольшее применение в челюстно-лицевой хирургии и нейрохирургии получили спеченные керамические, стеклокристаллические имплантационные материалы и костные цементы, содержащие в качестве основных фаз фосфаты кальция: гидроксиапатит и трехкальциевый фосфат. В основе создания данных материалов лежит предположение о необходимости воссоздания в составе имплантационных материалов фаз, близких к составу естественной минерализованной костной ткани. Следует отметить, что данные материалы, содержащие более 90 % (здесь и далее масс %) различных фосфатов кальция, обладают достаточно низкими прочностными свойствами – преимущественно 5-10 МПа, максимально – 25 МПа, характеризуются достаточно узким диапазоном размеров пор – до 50 мкм, низкой склонностью к ассимиляции объема материала остеогенными и фиброгенными клетками. Опыт применения данных видов имплантационных материалов показывает, что при подсадке в организм они выступают в виде пассивного костного матрикса, длительно сохраняют свою стабильность и, в некоторых случаях, пожизненно остаются в зоне имплантации.
Следует отметить, что для восстановления целостности костных структур имплантационный материал должен активно участвовать в биогенных процессах, инициировать протекание регенеративных процессов в костном ложе на клеточном и биохимическом уровнях и должен обладать:
- биоактивностью, биосовместимостью, отсутствием токсических реакций при взаимодействии с физиологическими средами организма;
- гидрофильностью, обеспечивающей закрепление, пролиферацию и дифференциацию остеогенных клеток;
- способностью поддерживать протекание процессов биоминерализации за счет содержащихся в составе кальций-фосфатных соединений;
- размером пор: малых 10-50 мкм, необходимых для адсорбции из плазмы крови и межклеточной среды биологических молекул и факторов роста, и крупных 50-500 мкм, необходимых для ассимиляции объема материала костными клетками;
- рН водной вытяжки 7,0-8,0, близкой к рН костной ткани;
- высокой пористостью с долей открытых пор на уровне 15-60 %, в зависимости от типа восстанавливаемой костной ткани (кортикальной или трабекулярной);
- рентгеноконтрастностью;
- прочностью на уровне 20-50 МПа, соответствующей прочности костной ткани;
- возможность стерилизации (сухожаровым способом, γ-излучением) без нарушения состава и структуры материала;
- технологичностью и возможностью механической обработки.
Созданный на базе РХТУ им. Д.И. Менделеева имплантационный материал БКС на основе нейтрального алюмоборосиликатного стекла и гидроксиапатита кальция, обладает гидрофильностью, уровнем рН водной вытяжки в пределах 7,4-8,0, ячеисто-канальной поровой структурой, размером пор в пределах 100-500 мкм и сравнимыми с костной тканью показателями прочности [1]. Его модификация – пористый имплантационный материал Орион-МБ в химическом составе дополнительно содержит микропористый цеолит; оптимизация технологии его производства позволила получать изделия бимодальной пористости с размером малых пор 10-50 и крупных пор – 50-500 мкм и более высокой прочностью, при этом технология получения данного материала позволяет воссоздавать естественные костные структуры [2]. Недостатком имплантационных материалов БКС и Орион-МБ является высокая химическая устойчивость данных материалов, которая обусловлена использованием в их составе нейтрального алюмоборосиликатного стекла и высокоустойчивого гидроксиапатита кальция.
Значительный вклад в развитие материалов, инициирующих процессы регенерации костной ткани, внесли работы: Е. Карлисл, Л. Хенча, О. Андерсона, К. Карлсона и др, доказавшие в экспериментах in vitro и in vivo важную роль кремния и растворимых силикатов в процессах формирования молодого коллагенового матрикса кости (остеоида) и его дальнейшей минерализации [3]. Л. Хенч [4], О. Андерсон и К. Карлсон [5] определили, что составы биоактивных стекол систем Na2O-CaO-P2O5-SiO2 и Na2O-CaO-P2O5-SiO2-Al2O3-B2O3 содержат не более 60 % (мол.) SiO2, высокие концентрации оксидов натрия и кальция, и высокое CaO/P2O5 отношение. При имплантации биоактивных высокощелочных стекол, под действием физиологических сред организма, на их поверхности формируются слои силикагеля, на которых закрепляются остеогенные клетки и происходит формирование коллагенового матрикса кости. Ионы Na+, K+ Ca2+, PO43-, выделяющиеся из объема материала
в контактную среду, участвуют в минерализации коллагенового матрикса с образованием карбонатапатита и, тем самым, активно участвуют в собственной регенерации костной ткани.
В работе [6] на основе высокощелочного стекла системы Na2O-CaO-P2O5-SiO2 и кальций-дефицитного гидроксиапатита разработан имплантационный мате-риал БАК-РД, характеризующийся высокой гидро-фильностью, регулируемыми пористостью и проч-ностью, способностью к активной резорбции в физиологических средах. Данный материал способен участвовать в остеогенных процессах, обеспечивать закрепление клеток, активный рост и формирование костной ткани в объеме материала. Следует отметить, что недостатком данного имплантационного материала является высокая склонность матричного стекла к кристаллизации в интервале температур спекания и достаточно высокий уровень рН водной вытяжки – до 9,5.
Для повышения лекарственной емкости имплантационных материалов и создания бимодальной поровой структуры в работе [2] предложено использовать микропористый цеолит. В исследованиях М. Санчес установлено формирование кальций-фосфатных слоев, близких к составу гидроксиапатита на поверхности синтетических цеолитов при их выдержке в растворе, близком по составу к плазме крови (Simulated Body Fluid) [7]. В работе К. Ферлинга [8] в исследовании клеточных культур показано, что алюмосиликатный цеолит натрия увеличивает пролиферацию костных клеток и производство внеклеточного матрикса. Применение цеолита в составе костных имплантационных материалов обусловлено как химическим составом, так и высокой собственной микропористостью, что позволяет насыщать имплантационный материал лекарственными препаратами в предоперационный период, активируя специфические клеточные реакции организма на имплантат; при подсадке в костное ложе – адсорбировать в собственном объеме из окружающей физиологической среды значительное количество белков, факторов роста – питательных веществ, необходимых для роста остеогенных клеток; активно участвовать в ионообменных процессах биогенных элементов; обеспечивать закрепление, пролиферацию и дифференциацию клеток.
Целью настоящей работы является: разработка технологии получения многокомпонентных биоко-мпозиционных материалов для костной пластики на основе нейтрального и высокощелочного стекол, кальций-дефицитного гидроксиапатита и микро-пористого цеолита, обладающих бимодальной поровой структурой, высокой долей открытых пор, достаточной прочностью и уровнем рН водной вытяжки до 8,0.
Материалы и методы. В качестве компонентов биокомпозиционного материала были выбраны:
- нейтральное матричное стекло НС-2А состава: Na2O – 11,0, K2O – 2,0, B2O3 – 2,5, Al2O3 – 3,5, MgO – 1,0, CaO – 7,0, SiO2 – 73,0, введение которого обеспечивает в интервале температур обжига протекание процесса спекания и порообразования;
- высокощелочное матричное стекло БС состава: Na2O - 25, CaO - 20, SiO2 - 50, P2O5 – 5, введение которого способствует повышению гидрофильности и биоактивности материала в условиях in vivo;
- наполнитель – кальций дефицитный гидрокси-апатит Ca9(PO4)6(OH)2, введение которого позволяет поддерживать протекание процессов биоминерализации за счет высвобождения из материала Ca2+, PO43- -ионов в условиях in vivo;
- наполнитель – микропористый цеолит Сокриницкого месторождения состава клиноптилолита и структурной формулой Mm/n[(Al2O3)x(SiO2)y]•zH2O (где х+у – сумма тетраэдров в элементарной ячейке, m – число катионов М, n – валентность катиона); введение цеолита позволяет обеспечить наличие большого количества открытых пор малых размеров (10-50 мкм) и, тем самым, повысить лекарственную емкость материала;
- газообразователь – карбонат кальция CaCO3, введение которого (сверх 100%) позволяет формировать в материале поры крупного размера (50-500 мкм).
Стекла варили в газовой печи при температуре Т=1400 °С, отжигали при температуре Т=500°С в течение 1 часа, далее измельчали в шаровой мельнице до гранул требуемого размера.
Технология получения пористых биокомпо-зиционных материалов включала:
- раздельное измельчение стекла НС-2А до гранул размером менее 80 мкм и стекла БС до гранул размером 200-400 мкм;
- совместную грануляцию кальций-дефицитного гидроксиапатита и цеолита (ГАЦ) до гранул размером 200-400 и 400-900 мкм (соотношение ГА:Ц составляло 50:50);
- составление рабочих смесей на основе матричных стекол НС-2А, БС, наполнителя – микропористых гранул ГАЦ и карбоната кальция;
- укладка рабочих смесей в формы;
- обжиг и механообработка заготовок.
Обжиг заготовок проводили в электрической муфельной печи СНОЛ 10/10 по режиму: нагрев до температуры обжига 820 (серия 1) или 850 ºС (серия 2), выдержка 45 мин, последующий отжиг. Состав материалов представлен в таблице 1.
Качественный рентгенофазовый анализ (РФА) образцов, обожженных при температурах 820 и 850ºС с изотермической выдержкой в течении 45 мин, проводили на дифрактометре «ДРОН-3М» с ионизационной регистрацией лучей в диапазоне углов 2θ = 20-70 град. Расшифровку рентгенограмм проводили на основе картотеки дифракционных паспортов ASTM.
Дилатометрические исследования (ДТА) цеолита проводили на горизонтальном дилатометре DIL 402 PC. Скорость нагрева образцов составляла 5 ºС/мин.
Пористость образцов (общую, открытую, закрытую) определяли по стандартной методике насыщением в керосине.
Водопоглощение и скорость пропитки определяли по стандартной методике насыщением в дистиллированной воде.
Исследование механических характеристик проводили по стандартной методике на разрывной машине.
Таблица 1 - Составы для получения композиционных материалов
|
№ пп |
Маркировка образцов |
Состав, масс % |
Фракция наполнителя ГАЦ, мкм |
Тобж, °С |
||||
|
Стекломатрица |
Наполнитель |
Газообра-зователь |
||||||
|
НС-2А |
БС |
Ca9(PO4)6(OH)2 |
Цеолит |
CaCO3 |
||||
|
1 |
70:30:900:820 |
56 |
14 |
15 |
15 |
4 |
900-400 |
820 |
|
2 |
60:40:900:820 |
48 |
12 |
20 |
20 |
|||
|
3 |
50:50:900:820 |
40 |
10 |
25 |
25 |
|||
|
4 |
70:30:400:820 |
56 |
14 |
15 |
15 |
400-200 |
||
|
5 |
60:40:400:820 |
48 |
12 |
20 |
20 |
|||
|
6 |
50:50:400:820 |
40 |
10 |
25 |
25 |
|||
|
7 |
70:30:900:850 |
56 |
14 |
15 |
15 |
900-400 |
850 |
|
|
8 |
60:40:900:850 |
48 |
12 |
20 |
20 |
|||
|
9 |
50:50:900:850 |
40 |
10 |
25 |
25 |
|||
|
10 |
70:30:400:850 |
56 |
14 |
15 |
15 |
400-200 |
||
|
11 |
60:40:400:850 |
48 |
12 |
20 |
20 |
|||
|
12 |
50:50:400:850 |
40 |
10 |
25 |
25 |
|||
Оценку потери массы материалов проводили в дистиллированной воде с рН=6,6 на 1, 2, 3, 7, 14 и 28 сутки.
Определение рН среды, находящейся в контакте с композиционными материалами, выполняли на лабораторном иономере И-160М. Отношение массы композиционного материала к массе дистиллированной воды составляло 1/10. Измерения рН контактной среды проводили на 1, 7 и 28 сут. пребывания образцов в дистиллированной воде.
Результаты и обсуждение
Анализ фазового состава композиционных материалов. Цеолит, используемый в составе композиционного материала представлен, по данным поставщика, следующими фазами, масс %:
- Клиноптилолитом, (Na,К,Ca)5Al6Si30О72∙18H2О –75;
- Морденитом, Сa2(Na, K)4[AI8Si40О96]∙28H2О < 10;
- Кварцем, SiО2 – 12;
- Гидрослюдой, К1-1,5Al4[Si6,5-7Al1-1,5О20](OH)4 – 2;
- Монтмориллонитом, AI2[OH]2[Si4O10]∙nH2O < 5.
По данным ДТА установлено, что в интервалах температур 50-200 и 200-900°С цеолит соответственно теряет физически и химически связанную воду. В интервале температур до 900°С цеолит сохраняет стабильность и выше данной температуры частично разлагается, что на термограмме отображается началом эндотермического эффекта.
Расшифровка рентгенограмм композиционных материалов серии 1 (Тобж=820°С) и серии 2 (Тобж=850°С) показала, что состав композиций представлен фазами:
- β-трехкальциевым фосфатом, и кремний-структурированным гидроксиапатитом, присутствие которых обусловлено разложением кальций-дефицитного гидроксиапатита высокощелочной стекломатрицей;
- клиноптилолитом, морденитом, кварцем, присутствующими в составе цеолита;
- натриево-кальциевым силикатом Na15,78Ca3[Si6O12], и кальциевым силикатом CaSiO3, присутствие которых обусловлено кристаллизацией высокощелочной стекломатрицы;
- стеклофазой, образованной преимущественно плавлением стекла НС-2А.
Интенсивность пиков указанных фаз изменяется в зависимости от соотношения стекломатрица : наполнитель в композициях и повышается с увеличением температуры обжига.
Анализ поровой структуры и механических свойств композиционных материалов. На основе исследований спекаемости композиций установлено, что состав № 12 – 50:50:400:850 не подвергается спеканию, что может быть связано с недостаточным количеством стекло-фазы, необходимой для обеспечения смачивания большего количества кристаллизующихся фаз данного состава и протекания процесса спекания. В дальнейших исследованиях данный композиционный материал не участвовал. Гистограммы изменения поровой структуры образцов серий 1 и 2 представлены на рисунках 1 и 2 соответственно.
 Рисунок 1 – Гистограмма изменения пористости образцов серии 1 (Тобж=820 °С)
Рисунок 1 – Гистограмма изменения пористости образцов серии 1 (Тобж=820 °С)
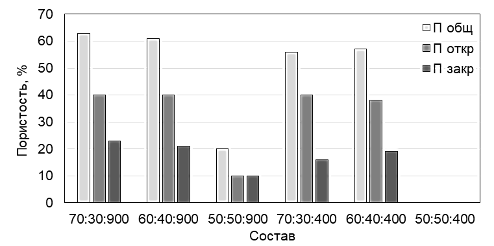 Рисунок 2 – Гистограмма изменения пористости образцов серии 2 (Тобж=850 °С)
Рисунок 2 – Гистограмма изменения пористости образцов серии 2 (Тобж=850 °С)
В общем случае параметрами регулирования поровой структуры в рассматриваемых сериях материалов являются: доля стекла в составе композиции и размер гранул наполнителя – ГАЦ.
Установлено, что в образцах с соотношением стекломатрица : наполнитель 70:30 и 60:40 общая пористость достигает 63 %, открытая пористость является преобладающей и находится в пределах 38-44 %, доля закрытых пор в этих образцах находится в пределах от 15 до 22 %. Объемная масса данных составов находится на уровне 480-650 кг/м3. В сравнении с композициями БКС, разработанные составы при том же соотношении стекломатрица: наполнитель (60:40 и 70:30) обладают большим водопоглощением и несколько более высокой скоростью пропитки, что объясняется наличием в составе микропористого цеолита. По параметру проницаемости для остеогенных клеток и доступности содержащихся в материале биоактивных наполнителей – β-Ca3(PO4)2 и Ca5(PO4)2(SiO4) данные составы перспективны для целей костно-пластической хирургии для восстановления трабекулярной костной ткани.
Образцы с соотношением стекломатрица: наполнитель 50:50 характеризуются более плотной структурой, что связано с меньшей долей стекломатрицы, подвергающейся вспениванию карбонатным порообразователем. Общая пористость составов находится на уровне 15-25 %, доля открытых пор составляет 5-15 %, объемная масса достигает 800-900 кг/м3. По параметру проницаемости данные составы не рекомендованы для использования в качестве имплантационных материалов.
Гистограммы прочности композиционных материалов серий 1 и 2 представлены на рис. 3 и 4 соответственно.
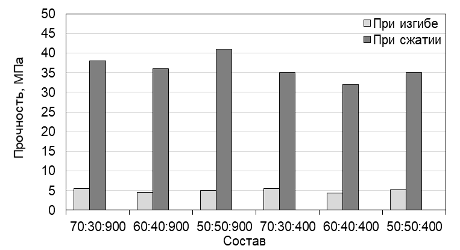 Рисунок 3 – Гистограмма изменения прочности образцов серии 1 (Тобж=820 °С)
Рисунок 3 – Гистограмма изменения прочности образцов серии 1 (Тобж=820 °С)
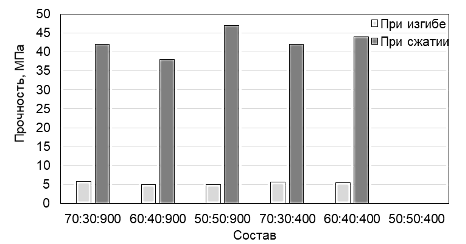 Рисунок 4 – Гистограмма изменения прочности образцов серии 2 (Тобж=850 °С)
Рисунок 4 – Гистограмма изменения прочности образцов серии 2 (Тобж=850 °С)
Анализ результатов определения прочности исследуемых композиционных материалов показывает, что общая пористость не оказывает заметного влияния на прочность. Однако, с увеличением температуры обжига прочность образцов незначительно увеличивается. Так, для образцов серии 1, обожженных при 820 °С прочность при сжатии находится в пределах 33-42 МПа, прочность при сжатии образцов серии 2, обожженных при 850 °С находится в пределах 38-47 МПа. По параметру прочности при сжатии данные составы могут быть использованы для восстановления трабекулярной костной ткани.
Анализ растворимости и рН композиционных материалов при выдержке в водных средах
Результаты определения потери массы композиционных материалов в дистиллированной воде с рН=6,6-6,7 составов 60:40:900 первой и второй серий, обожженных соответственно при 820 и 850 °С представлены на рис. 5.
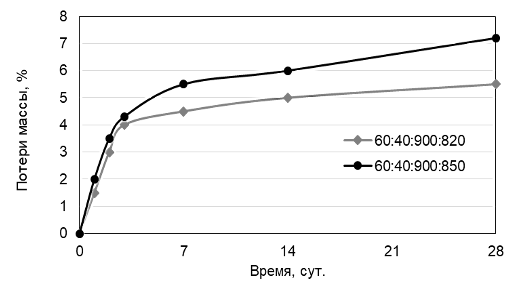 Рисунок 5 – График потери массы образцов серий 1 и 2 в дистиллированной воде
Рисунок 5 – График потери массы образцов серий 1 и 2 в дистиллированной воде
Кривые потери массы свидетельствуют о растворимости полученных композиционных материалов со временим, что обусловлено присутствием в материале растворимых фаз – β-Ca3(PO4)2, Ca5(PO4)2(SiO4) и Na15,78Ca3[Si6O12]. Кривые потери массы имеют вид кривых насыщения, при этом в первые трое суток происходит активное растворение поверхностных слоев и сглаживание микро-неоднородностей, с третьих суток наблюдается более равномерное растворение объема композиционного материала. Следует отметить. что угол наклона кривых потери массы композиционных материалов, обожженных при 850 °С несколько больше, что связано с более высокой долей содержания кристаллических фаз, участвующих в процессе растворения – β-Ca3(PO4)2, Ca5(PO4)2(SiO4) и Na15,78Ca3[Si6O12], в данном образце, в сравнении с образцом того же состава, обожженного при 820 °С.
Измерения рН среды, контактирующей с композиционными материалами, показывает, что в первые 7 сут рН контактной среды повышается до уровня 7,7-7,9 для составов соответственно обожженных при 820 и 850 °С, что коррелирует с данными по растворимости данных материалов. На 28 сут выдержки рН контактной среды составляет 8,0-8,2 для составов, соответственно обожженных при 820 и 850 °С. Повышение уровня рН водной среды, находящейся в контакте с композиционными материалами, относительно нейтральных значений обусловлена выделением в контактную среду Ca2+, Na+, PO43- -ионов. Анализ растворимости и оценка уровня рН контактной с композиционным материалом среды показывает, что разработанные материалы гидрофильны, подвергаются растворению, поддерживают требуемый уровень рН и могут быть использованы для целей костно-пластической хирургии.
Выводы
В настоящей работе впервые разработаны составы и отработана технология получения многокомпонентных биокомпозиционных материалов на основе нейтрального и высокощелочного матричных стекол и наполнителей – кальций дефицитного гидроксиапатита и микропористого цеолита.
В работе получены высокопористые полими-неральные биокомпозиционные материалы с бимодальным распределением пор по размерам с размером малых пор – 10-50 мкм, и крупных пор – 50-500 мкм; обладающие высокой открытой пористостью на уровне 38-44 %, объемной массой на уровне 480-650 кг/м3, прочностными характеристиками на уровне 33-42 МПа, рН водной вытяжки в пределах 7,7-8,2 и способных к резорбции в водных средах.
Установлено, что введение цеолита способствует образованию в материале открытых пор малых размеров, повышает проницаемость композиционных материалов, определяет уровень их биологической доступности для колонизации материала костными клетками и циркуляции межклеточных жидкостей в объеме имплантата.
Показано, что повышению доли открытой пористости способствуют следующие факторы: введение газообразователя, увеличение доли стекла в композиции и использование в составе материалов наполнителей большего гранулометрического размера.
Полученные материалы удовлетворяют комплексу требований, предъявляемых к имплантационным материалам. По показателям пористости и прочности оптимальны для восстановления трабекулярной костной ткани составы с отношение стеклофазы и наполнителя равные 70:30 и 60:40.
1. Пат. 2479319 Российская Федерация, МПК A61L27/42, A61L27/12, A61F2/28. Биокерамика силикокальцийфосфатная («БКС») и способ ее изготовления / Шаповалов А.Б., Солунин В.Л., Гурский Б.Г., Власова Е.Б., Шуйский В.И., Никитин А.А., Кедров А.В., Царев В.Н. – № 2011146171/15; заявл. 15.11.2011; опубл. 20.04.2013. Бюл. No 11.
2. Мастрюкова Д.Л., Белецкий Б.И., Полухина О.В. Стеклокерамика с регулируемой поровой структурой для медицины // Стекло и керамика. - 2007. - № 4. – С. 23-26.
3. Carlisle E. Si: a possible factor in bone calcification // Science. – 1970. – Vol. 167. – P. 279-280.
4. Hench L. The story of Bioglass // Journal of Materials Science: Materials in Medicine. – 2006. – Vol. 17. – P. 967-978.
5. Andersson O.H., Karlsson K.H. On the bioactivity of silicate glass // J. Non-Cristalline Solids. - 1991. – Vol. 129. – P. 145-151.
6. Свентская Н.В., Белецкий Б.И., Лукина Ю.С. Регулирование поровой структуры высокощелочных кальцийсиликофосфатных биокомпозиционных материалов для костно-пластической хирургии // Техника и технология силикатов. – 2017. – Т. 24. . – № 4. – С. 17-23.
7. Sanchez-Roblesn M., Gamero-Melo P., Cortes-Hernandez D. In vitro hydroxiapatite formation on the Ca doped surface of ZSM-5 [Ga] type zeolite // Ceramics International. – 2013. – 39. – P. 7387–7390.
8. Firling C., Evans G., Wakley G., Sibonga J., Turner R. Lack of an effect of sodium zeolite A on rat tibia histomorphometry // Journal of Bone and Mineral Research. – 1996. – Vol. 11. – Iss. 2. – P. 254-263.









